Start Weiter
Paul J. Crutzen
Menschliche Einflüsse auf das Klima und die Chemie der globalen Atmosphäre
1. Einleitung
25-48
Abgesehen von variablen Beimischungen (Wasserdampf, bis zu etwa 1-2% nahe der Erdoberfläche), besteht die Atmosphäre zu mehr als 99,9% Volumenprozenten aus molekularem Stickstoff (N2), Sauerstoff (O2) und dem Edelgas Argon (Ar). Diese Gase sind chemisch so stabil, daß sie sogar bis zu Höhen von etwa 100 km gut durchmischt in Volumenverhältnissen von etwa 78, 21 und 1% vorkommen. Erst in größeren Höhen führen die Schwerkraft der Erde und die Wirkung der intensiven solaren Ultraviolettstrahlung (UV-Strahlung) zu deutlichen Änderungen der relativen Häufigkeiten von N2, O2 und Ar.
An den wichtigsten chemischen Prozessen in der Atmosphäre sind hauptsächlich Gase beteiligt, deren Konzentrationen um viele Größenordnungen geringer sind als die von Stickstoff, Sauerstoff und Argon. Das wichtigste dieser Gase ist Ozon (O3). Es kommt hauptsächlich in der Stratosphäre oberhalb von 10-15 km vor und erreicht bei ungefähr 30 km Höhe ein maximales Mischungsverhältnis von nur etwa zehn auf eine Million Luftmoleküle.
In der Troposphäre, dem unteren Stockwerk der Atmosphäre, das sich bis zu etwa 10 km Höhe in mittleren Breiten und bis 16 km in den Tropen erstreckt, ist die relative Häufigkeit von Ozon etwa 100-1000 Mal geringer als in der Stratosphäre. Dennoch sind sowohl das troposphärische Ozon, obwohl eigentlich ein Schadgas, als auch die UV-Strahlung, obwohl biologisch schädlich, von größter Bedeutung für die Reinhaltung unserer atmosphärisch-chemischen Umwelt. Auf diesen merkwürdigen Sachverhalt werden wir in diesem Artikel noch zurückkommen.
Ozon ist das einzige Gas in der Atmosphäre, das UV-Strahlung von der Sonne im Wellenlängenbereich von 240-310 nm (1 nm = 1 Milliardstel Meter) in nennenswertem Umfang absorbieren kann; zuviel von dieser Strahlung wäre schädlich für das Leben auf der Erde. Sie verursacht z. B. Hautkrebs und grauen Star bei Menschen, es hemmt die Photosynthese in vielen Pflanzen und kann besonders empfindlich das Meeresplankton schädigen. Man kann mit Sicherheit davon ausgehen, daß das Leben auf der Erde, wie wir es jetzt kennen, ohne den Ozonschutz gegen UV-Strahlung nicht möglich gewesen wäre.
Wieviel von dieser UV-Strahlung bis auf den Erdboden durchdringen kann, hängt außerordentlich empfindlich von der Gesamtmenge des Ozons in der Atmosphäre ab. Könnte man das gesamte atmosphärische Ozon auf den Druck am Erdboden komprimieren, ergebe sich eine Luftschicht, die im Mittel nur etwa 3 mm dick wäre. Wie wir in diesem Artikel zeigen werden, kann dieser "Ozon-Schild" gegen die UV-Strahlung durch menschliche Einwirkungen stark angetastet werden.
Die Absorption der solaren UV-Strahlung durch Ozon ist außerdem eine wichtige Energiequelle für die Stratosphäre, die bewirkt, daß die Temperaturen dort - bis zu etwa 50 km - mit der Höhe zunehmen. Eine solche sogenannte Temperaturinversion stabilisiert die Atmosphäre, es hemmt den vertikalen Luftaustausch, es führt deshalb zu langen Verweilzeiten in der Stratosphäre, und es verhindert außerdem das Eindringen von Gewittern in die Stratosphäre. Das stratosphärische Ozon hat deshalb auch eine erhebliche Bedeutung für die Niederschlagsprozesse und das Klima der Erde.
Ozon in der Stratosphäre entsteht aus der Photodissoziation des molekularen Sauerstoffs durch Einwirkung der solaren UV-Strahlung mit Wellenlängen kürzer als 240 nm; die entstehenden Sauerstoffatome verbinden sich dann mit molekularem Sauerstoff zu Ozon. Man kann die photochemischen Reaktionen, die so stattfinden, mit folgender Formel vereinfacht zusammenfassen:
3 O2 ( + UV Strahlung) => 2 O3 (Schema 1)
Da der Sauerstoff in der Atmosphäre zum größten Teil in der Form von O2 vorliegt, muß es offensichtlich Prozesse geben, die 03 wieder in O2 zurückverwandeln. Die Forschung hat in den letzten 20 Jahren gezeigt, daß einige relativ selten vorkommende Bestandteile der Luft eine wesentliche Rolle beim chemischen Abbau des stratosphärischen Ozons spielen. Die Reaktionsketten, die dabei ablaufen, lassen sich durch folgendes Schema zusammenfassen:
2 O3 + X + XO + Sonnenstrahlung—3O2 + XO + X (Schema 2)
In dieser Reaktionskette wird eine chemische Verbindung X in XO und XO wieder in X umgewandelt, wobei X und XO für bestimmte reaktive Gase stehen, welche im folgenden noch näher vorgestellt werden. Somit dienen X und XO als Katalysatoren, die die Umwandlung von O3 zu O2 sehr stark beschleunigen, ohne dabei selbst verbraucht zu werden. Es handelt sich hierbei ausschließlich um Radikale, d.h. Atome und Bruchstücke von Molekülen mit einer ungeraden Anzahl an Elektronen und deshalb sehr reaktionsfreudig. In der natürlichen Stratosphäre sind die wichtigsten Katalysatoren die Stickoxide NO und NO2 (d.h. in Schema 2; X = NO und XO = NO2). Sie entstehen bei der Oxidation von Lachgas (N20), das hauptsächlich durch bakterielle Prozesse zusammen mit N2 und NO, als flüchtige gasförmige Zwischenprodukte, im Stickstoffkreislauf der Böden erzeugt wird und von dort in die Atmosphäre entweicht.
26
N2O ist ein sehr stabiles atmosphärisches Gas, das erst in der Stratosphäre durch UV-Strahlung von der Sonne angegriffen wird und deshalb eine durchschnittliche Lebensdauer von 150-200 Jahren in der Atmosphäre hat. Die Stickoxide NO und NO2, oft zusammengefaßt als NOx, die an der Erdoberfläche, besonders auch durch menschliche Aktivitäten, in großen Mengen erzeugt werden, können dagegen nicht in die Stratosphäre gelangen, da ihre Aufenthaltszeit in der Atmosphäre nur einige Tage beträgt. Sie bilden deshalb keine Gefahr für die stratosphärische Ozonschicht. Jedoch, wie wir noch besprechen werden, spielen sie eine wichtige Rolle bei der Bildung des Ozons in der Troposphäre. Obwohl die gesamte Abgabe der NOx-Gase erheblich größer ist als die von N2O, ist das durchschnittliche Mischungsverhältnis von N2O etwa 300, dagegen das von NOx weniger als 0,1 auf einer Milliarde Luftmoleküle.
Wie das Lachgas, sind auch mehrere vollständig halogenierte, industriell erzeugte organische Verbindungen chemisch so stabil, daß sie nur in der Stratosphäre durch ultraviolette Sonnenstrahlung abgebaut werden können. Von besonderer Bedeutung sind CC14 und die sogenannten Fluorchlorkohlenwasserstoff (FCKW)-Gase CFC13, CF2C12 und C2F3CI3, die weltweit jährlich mit einer Gesamtmenge von fast einer Million Tonnen in die Atmosphäre abgegeben werden, meist als Kühlmittel in Kühlaggregaten, zum Aufschäumen von Schaumstoffen, sowie als Treibgase in Spraydosen. Die Emission dieser Gase führt seit etwa 30 Jahren zu einer ständigen Zunahme ihrer Konzentrationen in der Atmosphäre. Von besonderer Gefährdung für die Ozon-Schicht in der Stratosphäre sind dabei CFCI3 und CF2CI2, deren atmosphärische Konzentration zur Zeit mit etwa 4% jährlich zunehmen. Sie können erst in Höhen oberhalb von 25 km durch die UV-Strahlung von der Sonne zerstört werden; dabei werden Chloratome (Cl) freigesetzt.
Pro Molekül gerechnet sind Cl und seine Sauerstoffverbindung CIO bei der katalytischen Ozon-Zerstörung (X = C1; XO = C10 in Schema 2) sogar noch wirksamer als NO und NO2. So kann ein Cl-CIO Paar, zusammengefaßt C10x, in der Stratosphäre um die hunderttausend Ozonmoleküle vernichten, bevor es wieder aus der Atmosphäre entfernt wird. Modellrechnungen ließen deshalb schon seit längerer Zeit erwarten, daß die ständig steigenden Konzentrationen der FCKW-Gase zu beträchtlichen Abnahmen der Ozon-Konzentration in der Stratosphäre, besonders oberhalb von 25 km Höhe, führen dürften. Für niedrigere Höhen waren die Aussagen viel unsicherer und ließen bis vor kurzem sogar eine Erhöhung des Ozon-Gehaltes vermuten. Dies erklärte sich u.a. dadurch, daß die ozonbildende solare UV-Strahlung dank der geringeren Ozon-Konzentration in den oberen Schichten dann auch tiefer in die Atmosphäre eindringen kann, um dort Ozon zu bilden; dazu kommen die chemischen Wirkungen erhöhter atmosphärischer Methan(CH4)-Konzentrationen, die das C10x-Radikalpaar stärker in die chemisch viel stabilere Salzsäure (HCl) umwandeln, sowie anderer ziemlich komplexer chemischer Zusammenhänge, auf die wir hier nicht weiter eingehen wollen.
27
Man sollte an dieser Stelle bemerken, daß es in der unteren Stratosphäre, unterhalb von 30 km, noch sehr an Messungen zum Testen der theoretischen Modellrechnungen mangelt. Bis vor einigen Jahren wurde aber erwartet, daß die Höhenverteilung des Ozons sehr stark, dagegen die Gesamtsäule Ozon viel weniger, durch die Zunahme der FCKW-Gase abnehmen würde. Das plötzlich auftretende Ozonloch hat aber anderes gezeigt und alle Atmosphären-Chemiker völlig überrascht.
2. Der große Schock: das Ozonloch
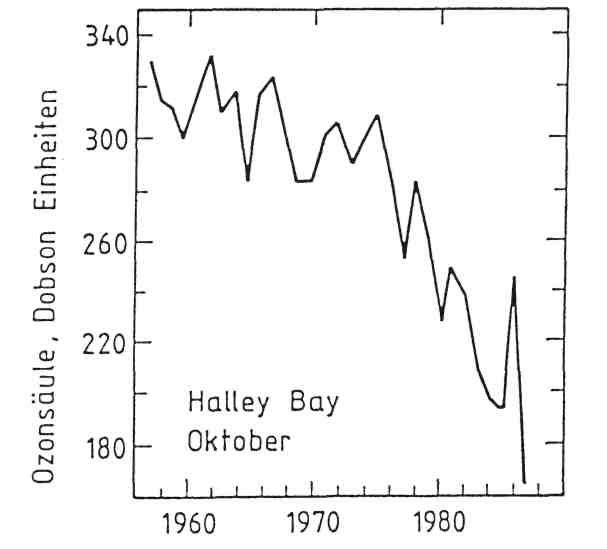
Seit Beginn des Internationalen Geophysikalischen Jahres 1958-1959 werden regelmäßige Messungen des Gesamtozons an mehreren Bodenstationen in der Antarktis durchgeführt. Als besonders wichtig haben sich Langzeitmessungen an der britischen Station Halley Bay (76° S, 27°W) erwiesen. Wie Abbildung 1 zeigt, sind im antarktischen Frühlingsmonat Oktober seit Ende der 70er Jahre drastische Abnahmen des Gesamtozons eingetreten, wie sie bis dahin nicht beobachtet wurden. Messungen von Satelliten aus haben gezeigt, daß die starken Ozonabnahmen über dem ganzen antarktischen Kontinent auftreten.
Weitere wichtige Informationen lieferten Messungen der vertikalen Ozonverteilungen, die ebenfalls über Halley Bay ausgeführt wurden. Sie zeigen Abnahmen der Ozonkonzentration in den Monaten August-September, besonders in der unteren Stratosphäre zwischen etwa 13 und 22 km Höhe. Es ist klar, daß an Stelle des gewöhnlichen Ozonmaximums in diesem Höhenbereich innerhalb von zwei Monaten ein Minimum entstanden ist, das sogenannte Ozonloch (s. Abbildung 2). Selbstverständlich hat die Ursache für diese ungewöhnlich drastische Entwicklung die Stratosphärenforscher in den vergangenen Jahren sehr stark engagiert. Durch gezielte innovative Forschung wurden innerhalb nur weniger Jahre die hauptsächlichen Ursachen für das plötzliche Auftreten des antarktischen Ozonlochs aufgedeckt. Zunächst geben wir eine kurze Darstellung dieser Ursachenzusammenhänge, um gleichzeitig einige Verwirrungen auszuräumen, die in den letzten Jahren durch verschiedene Presseberichte entstanden sind.
28
Abbildung 1:
Die mittlere Gesamtsäulendichte von Ozon des Monats Oktober über der britischen antarktischen Station Halley Bay (76° S) zwischen den Jahren 1957 und 1984. (100 Dobson Einheiten entspricht 1 mm Ozon bei Normaldruck von einer Atmosphäre).

Obwohl Ozon durch photochemische Prozesse erzeugt wird, wurde schon vor etwa 60 Jahren erkannt, daß die Abhängigkeit des Gesamtozons von Breite und Jahreszeit nur durch dynamische Prozesse in der unteren Stratosphäre erklärt werden kann. Es lag deshalb nahe, daß als Hauptursache für die beobachteten Ozonabnahmen zuerst geänderte meteorologische Bedingungen in der unteren Stratosphäre vorgeschlagen wurde. Dabei wurde das beobachtete Ozonminimum vor allem auf einen Aufwärtstransport ozonarmer Luft aus der Troposphäre in die Stratosphäre zurückgeführt. Messungen einiger Spurenstoffe troposphärischen Ursprungs in der unteren Stratosphäre, die während der Meßkampagnen amerikanischer Wissenschaftler in der Antarktis in 1987 und 1988 durchgeführt wurden, schließen aber eine derartig geänderte Dynamik der unteren Stratosphäre als Hauptursache für das Ozonloch eindeutig aus.
29
Die über der britischen antarktischen Station Halley Bay (76° S) gemessenen Höhenprofile der Ozonkonzentrationen am 15. August und 13. Oktober 1987.Abbildung 2:

30
Falls nämlich eine Aufwärtsbewegung aus der Troposphäre in die Stratosphäre stattgefunden hätte, hätte man auch eine Zunahme charakteristischer troposphärischer Gase beobachten müssen. Dies ist aber nicht der Fall. Beobachtungen von Lachgas (N2O) zeigen stattdessen ungewöhnlich niedrige Konzentrationen dieses Gases in der unteren Stratosphäre, welche eindeutig auf Abwärtstransport aus höheren Schichten schließen lassen. Da ein solcher Transport eigentlich zu einer erhöhten Gesamtsäulendichte des Ozons führen müßte, ergibt sich, daß in den Monaten September und Oktober über der Antarktis ein starker chemischer Abbau des Ozons stattfinden muß. Die seit vielen Jahren stark angestiegenen Konzentrationen der FCKW-Gase gerieten bald in den Verdacht, das Ozonloch verursacht zu haben.
3. Die stratosphärischen Auswirkungen der FCKW-Gase
Unter natürlichen Bedingungen entstanden in der Stratosphäre anorganische gasförmige Chlorverbindungen nur aus Methylchlorid (CH3Cl), das mit einem Mischungsverhältnis von etwa 0,6 ppb (1 ppb entspricht ein Molekül auf eine Milliarde Luftmoleküle) in der Atmosphäre vorkommt und wohl hauptsächlich durch Meeresalgen gebildet wird. Durch industrielle Aktivitäten sind der Atmosphäre in den letzten 30 Jahren soviele organische Chlorverbindungen wie CCI4, CH3CCI3 und die FCKW-Gase CFC13, CF2C12 und C2F3C13 zugeführt worden, daß die Konzentrationen der anorganischen Chlorgase (HCl, C10x, C10NO2) in der Stratosphäre bis heute auf das vier- und fünffache des natürlichen Gehalts gestiegen ist.
1974 hatten die amerikanischen Forscher Molina und Rowland zuerst davor gewarnt, daß in Zukunft der weitere Ausstoß von FCKW-Gasen zu starken Ozonabnahmen führen würde. Heute wachsen die Konzentrationen der FCKW-Gase in der Stratosphäre jährlich um etwa 4%, obwohl die Emissionsraten weltweit kaum mehr zunehmen. Dieser für den Laien vielleicht etwas überraschende Tatbestand läßt sich dadurch erklären, daß augenblicklich noch immer 5-6 Mal so viel dieser Gase in die Atmosphäre abgegeben wird, als in der Stratosphäre durch UV-Strahlung abgebaut wird.
31
Die Chemie der Stratosphäre ist äußerst komplex. So ist die Ozonzerstörung durch die wachsende Konzentration der NOx (-0,2-0,3% pro Jahr) und vor allem der C10x-Radikale (~4% pro Jahr) nicht nur eine einfache Addition individueller Effekte. Es finden vielmehr wichtige Rückkopplungen statt, die das Ozon teilweise vor Zerstörung schützen, insbesondere durch die Reaktion:
CIO + NO2 + M-+C10NO2 + M
und das Reaktionspaar
C10 + NO^Cl + NO2 C1 + CH4^HC1 + CH3
Sowohl C10NO2 (Chlornitrat) wie auch HCl (Salzsäure) reagieren nicht mit Ozon, so daß die oben erwähnten Reaktionen das Ozon vor stärkerer Zerstörung als sonst möglich schützen. Solche weniger reaktive Moleküle wie HCl und CIONO2 werden oft als "Reservoir"-Moleküle bezeichnet, da sie nur durch weitere, relativ langsame Reaktionen wieder in reaktive C10x- und NOx-Radikale umgewandelt werden können. Zugleich zeigt sich aus obenstehender Gleichung, daß auch Methan eine günstige Auswirkung auf die stratosphärische Ozonkonzentration haben kann. Auch dieses atmosphärische Spurengas nimmt durch menschliche Aktivitäten um etwa 1% pro Jahr weltweit zu.
Insgesamt zeigt sich, daß die beschriebene chemische Wechselwirkung mit den NOx-Radikalen dazu beiträgt, den katalytischen Abbau des Ozons durch die stark zunehmenden Konzentrationen von ClOx-Radikalen zu bremsen, obwohl die NOx-Radikale selber auch zum Ozonabbau beitragen und in der natürlichen Atmosphäre sogar die Ozonbilanz fast total bestimmten. Der Effekt wird noch dadurch verstärkt, daß NO2 und HNO3 gemeinsam durch katalytische Reaktionen OH-Radikale abbauen und dadurch eine entscheidende Zurückbildungsreaktion HCl + OH—>C\ + H20 für die ozonabbauenden C10x( = Cl + C10)-Radikale bremsen.
32
4. Chemische Erklärung für das Auftreten des Ozonlochs
Seit Ende der 70er Jahre hat man durch damals angefangene Satellitenbeobachtungen entdecken können, daß sich in polaren Gebieten, und insbesondere über der Antarktis, in der normalerweise sehr trockenen und wolkenfreien Stratosphäre im Winter und frühen Frühjahr dünne Wolkenschleier von großer Ausdehnung bilden können. Es hat sich inzwischen gezeigt, daß diese sogenannten polaren stratosphärischen Wolken (Polar Stratospheric Clouds) bei der Bildung des Ozonlochs in folgender Weise eine große Rolle spielen.
Während der langen Polarnacht werden zuerst NO und NO2 durch Oxidationsreaktionen mit Ozon in N205 umgewandelt. Die N205-Moleküle werden dann bei den vorherrschenden tiefen Temperaturen durch Reaktion an den Oberflächen der Wolkenteilchen in Salpetersäuremoleküle (HNO3) umgewandelt, welche in den Wolkenteilchen eingebaut werden. Außerdem wurde neuerdings entdeckt, daß bei sehr tiefen Temperaturen auch Salzsäure in den Eispartikeln ausgefroren werden kann. An den Oberflächen der Partikel können die Reservoir-Moleküle C10NO2 und HCl durch die Reaktion
C10NO2 + HC1 (Eis)^Cl2 + HN03 (Eis)
und durch die nachfolgende Photolyse des gasförmigen Cl2 durch ultraviolette Sonnenstrahlung
Cl2 + UV-Strahlung^2Cl
im antarktischen Frühling sehr effektiv in stark reaktive C10x-Radikale umgewandelt werden.
Die Kombination der oben erwähnten Prozesse führt während des antarktischen Frühjahrs zu einer außergewöhnlich starken Anreicherung von C10x-Radikalen, die das Ozon in der unteren Stratosphäre besonders zwischen etwa 12-22 km durch eine katalytische Reaktionskette nach Schema 2
CIO + CIO + M^C12O2 + M
C12O2 + UV-Strahlung-^2Cl + O2
ci+o3^cio + o2
ci+o3^cio+o2
Netto: 203-*3 O2
sehr effektiv abbauen können.
33
Die Effizienz dieser Ozonabbaukette hängt quadratisch von der Konzentration von ClO ab und steigt somit sogar um etwa 2 x 4%, d.i. 8%, pro Jahr. Optische Messungen vom Boden aus, die über der amerikanischen Forschungsstation McMurdo gemacht wurden, haben in der Tat gezeigt, daß dort ungewöhnlich hohe Konzentrationen von CIO und vom Folgeprodukt OCIO vorkommen können. Insbesonders aber haben Prof. James Anderson und seine Mitarbeiter von der Harvard University im vergangenen September in der antarktischen Stratosphäre sehr hohe Konzentrationen des CIO-Radikals genau im Ozonloch nachgewiesen, wie sie die beschriebenen photochemischen Prozesse erwarten lassen.
Diese Messungen sind in Abbildung 3 schematisch zusammengefaßt. Sie zeigen am Ende des polaren Winters gegen Ende August schon das Vorkommen von ungewöhnlich hohen ClO-Radikal-Konzentrationen, aber noch keine starke Ozonabnahme. Ein ausgeprägtes Ozonloch hat sich aber einige Wochen später sehr deutlich entwickelt. Der Abbau des Ozons fordert außer dem Vorkommen relativ großer Konzentrationen von CIO auch die Sonnenstrahlung, da die C10x-Radikale aus der Photolyse von Cl2 und C12O2 entstehen.
Das Auftreten sehr kalter Temperaturen begünstigt die Aktivierung der Chlorchemie, da sie die Bildung der stratosphärischen Eisteilchen begünstigen. Die gemessenen ClO-Radikal-Konzentrationen sind mehrere hundert Mal höher als ohne die Gegenwart der Eisteilchen möglich gewesen wäre. Das bedeutet aber auch, daß meteorologische Prozesse einen Einfluß auf die Ozonlochbildung haben, da sie die vorherrschenden Temperaturen mitbestimmen. Daraus erklärt sich der ausgeprägte Rhythmus von zwei Jahren in den beobachteten Ozonabnahmen, welches wieder zur Folge hatte, daß das Ozonloch im September und Oktober 1988 erheblich weniger ausgeprägt war als 1987. In diesem Jahr kann man deshalb ein größeres Ozonloch voraussagen.
34
|
|
Abbildung 3: Darstellung der auf etwa 18 km Höhe im Breitengürtel 63°S-72°S gemessenen Mischungsverhältnisse von Chlormonoxid (CIO) (in ppb, d. i. Moleküle CIO pro Milliarde Luftmoleküle) und Ozon (in ppm: Moleküle Ozon pro Million Luftmoleküle) Ende August und Mitte September. Die Messungen wurden an Bord eines Forschungsflugzeugs der amerikanischen Raumbehörde durchgeführt.
|
Alles spricht also dafür, daß das Ozonloch, das während der letzten 10 Jahre im antarktischen Frühjahr aufgetreten ist, primär auf die stark gestiegenen Konzentrationen der FCKW-Gase (CFC13J CF2C12, CC14, QF3CI3) zurückzuführen ist. Wegen der langen Verweilzeit der FCKW-Gase in der Atmosphäre muß man leider erwarten, daß das Ozonloch sich erst in etwa 100 Jahren wieder schließen dürfte.
35
Glücklicherweise hat sich eine derart drastische Ozonabnahme im Nordpolargebiet noch nicht entwickelt. Dies ist damit zu erklären, daß hier die Temperaturen viel seltener so tief sinken, so daß sich viel weniger stratosphärische Wolkenteilchen bilden können. Dennoch hat eine umfassende Analyse der Ozontrends auf der Nordhalbkugel für die Jahre zwischen 1969 und 1986 für die Breitengürtel 30°-39°N, 40°-52°N und 53°-64°N Abnahmen der Jahresmittelwerte um 1,7%, 3,0% bzw. 2,4% gezeigt. Die stärksten Abnahmen in diesem Zeitraum traten dabei in den Wintermonaten auf und betrugen 2,3%, 4,7% bzw. 6,2% für die obenerwähnten Breitengürtel. Diese Abnahmen, vor allem die im Winter, sind größer, als es die Modellrechnungen vorhersagen; möglicherweise finden also auch über unsere Köpfe hinweg chemische Reaktionen statt, die den Abbau des Ozons über Erwarten beschleunigen.
Eine starke Einschränkung der weltweiten FCKW-Emissionen, die deutlich über die international vereinbarte Grenze von 50% der heutigen Emissionen nach dem Montreal-Protokoll bis zum Ende des Jahrhunderts hinausgeht, scheint deshalb dringend geboten. Auch bei Einhaltung dieses Abkommens würden die Konzentrationen der FCKW-Gase noch weiter ansteigen, da auch dann noch immer mehr FCKW-Gase in die Atmosphäre abgegeben werden als in der Stratosphäre abgebaut wird. Um eine Status-quo Situation zu erreichen, müßte die Produktion der FCKW-Gase um etwa 85% verringert werden. Eine Verbesserung der Situation würde somit noch strengere Maßnahmen, praktisch ein vollständiges FCKW-Produktionsverbot, erfordern. Aber auch unter diesen Bedingungen würde es trotzdem mehr als 100 Jahre dauern bis das stratosphärische Ozon wieder etwa seinen natürlichen Pegel erreichen könnte. Die industrialisierte Welt hat hier ein groteskes globales Umweltproblem erzeugt, vor dessen Folgen Wissenschaftler schon seit fast 15 Jahren gewarnt haben. Erst in jüngster Zeit wurden von Politik und Industrie die ersten, zögernden Maßnahmen zur Beschränkung der FCKW-Emissionen beschlossen.
36
5. Chemische Belastungen der globalen Chemie der Troposphäre
Obwohl eine Überdosis an UV-Strahlung schädlich für das Leben ist, ist sie andererseits von außerordentlich positiver Bedeutung für die chemische Reinhaltung der Atmosphäre. Dabei spielt auch die verhältnismäßig geringe Menge des Ozons in der Troposphäre, die nur einen Anteil von etwa 10% am Gesamt-Ozon ausmacht, eine wesentliche Rolle. Dieselbe UV-Strahlung mit Wellenlängen kürzer als etwa 310 nm, die lebende Zellen schädigt, zerlegt nämlich auch Ozon in ein Sauerstoffmolekül und ein elektronisch angeregtes Sauerstoffatom (O*). Dieses energiereiche O-Atom kann mit atmosphärischem Wasserdampf reagieren und erzeugt dabei reaktionsfreudige Hydroxyl-Radikale (OH):
O3 + UV-Strahlung => O* + O2 (< 310 nm)
O* + H2O => 2 OH
Die meisten Gase, die von der Natur oder durch menschliche Aktivitäten erzeugt werden, wie z.B. wasserstoffhaltige organische und anorganische Gase, Kohlenmonoxid, die NOx-Gase und Schwefeldioxid, werden durch OH-Radikale angegriffen. Die Lebensdauer der meisten Gase wird daher in der Atmosphäre durch ihre Reaktionsfreudigkeit mit OH bestimmt. Man kann deshalb OH ohne weiteres als das Waschmittel der Atmosphäre bezeichnen. Das geschätzte weltweite Mittel der OH-Konzentration liegt bei etwa 6 x 105 Molekülen pro cm3, d.h. bei einem Mischungsverhältnis von nur etwa 2-3 OH-Radikalen pro 100 Billionen Luftmoleküle. Dies ergibt sich aus Modellrechnungen und besonders aus Studien der globalen Konzentrationen von Methylchloroform (CH3CCI3). Dieses Gas, dessen Konzentrationen in der Atmosphäre gut bekannt sind, wird weltweit nur durch industrielle Prozesse und in relativ gut bekannten Mengen freigesetzt. Der Unterschied zwischen dem gesamten Ausstoß in die Atmosphäre in der Vergangenheit und den jetzt beobachteten Gesamtmengen ergibt somit den Methylchloroform-Verlust
37
und damit ein Maß für die weltweit gemittelten OH-Konzen-trationen. Es ist sehr erstaunlich, daß die Effizienz der Oxida-tionsvorgänge in der Atmosphäre in erster Linie von einem Gas mit einer so außerordentlich geringen Konzentration bestimmt wird, obwohl Sauerstoff 21% der Atmosphäre ausmacht. Sauerstoff ist aber verglichen mit Hydroxyl viel weniger reaktiv.
Tabelle 1: Klima- und ozonrelevante atmosphärische Gase deren atmosphärische Konzentrationen, mit Ausnahme derer von CsH8 (Isopren), durch menschliche Aktivitäten beeinflußt werden.
Mischungsverhä
ltnisVerweilzeit
Jä
hrliche ZunahmeODP
GWP
CO,
347 ppm
«
100 Jahre0,4-0,5%
—
1
CH4
1,7-1,8 ppm
10 Jahre
0,8-1%
-
2-3
C5H8
0-5 ppb
einige Stunden
-
-
-
CO
«
50-200 ppb1-6 Monate
?
-
-
NO,
0-100 ppb
einige Tage
0,2-0,3% (Stratosphä
re)0,25
—
N20
310 ppb
170 Jahre
0,2-0,3%
0,05
240
CH3CCI3
140 ppt
6-7 Jahre
3-4%
0,15
-
CHF2C1
70ppt
17-20 Jahre
12%
0,05
2000
CFCI3
225 ppt
55-70 Jahre
4%
1
8600
CF2C12
385 ppt
100-150 Jahre
5%
1,0
18 000
C2F3CI3
40 ppt
90-110
10%
1,0
22 000
CCU
140 ppt
50-70
2%
1,2
«
4000(?)CF2ClBr
2,2 pptv
'25 Jahre
«
10%2-3
-
CBrF3
2,1 pptv
110 Jahre
«
15%5-8
-
ppm, ppb, ppt = Volumenanteile der betreffenden Gase pro eine Million, eine Milliarde und eine Billion Luftmoleküle
ODP = Effizienz der pro Gewichtseinheit verursachten Ozonzerstörung im Vergleich zu der durch CFCI3 verursachten Ozonreduzierung
GWP = Klima-Erwärmungsfaktor im Vergleich zu dem von CO2 verursachten, gewichtet mit der atmosphärischen Verweilzeit. Dieser Faktor, wie in der Tabelle angegeben, bezieht sich also auf die atmosphärischen Emissionen. Wenn man die atmosphärischen Konzentrationen als Maßstab nimmt, würde sich der GWP-Wert für CPL um den Faktor 10 erhöhen.
38
Unter Verwendung dieser Information läßt sich die Lebensdauer für einige wichtige Gase in der Atmosphäre abschätzen (Tab. 1), welche im Bereich von Jahren bis hinunter zu wenigen Stunden liegt. Dies bedeutet, daß ein Gas wie Methan (CH4), das eine Lebensdauer von etwa 10 Jahren hat, weltweit ziemlich gleichmäßig verteilt ist, während Isopren (C5H8) und sonstige organische Verbindungen, die von der Vegetation in großen Mengen abgegeben wird, nur in der Nähe von "Waldgebieten in meßbaren Konzentrationen gefunden werden können. Der Abbau von Methan und anderen Kohlenwasserstoffen wie Isopren führt über längere Reaktionsketten, auf die hier nicht weiter eingegangen werden kann, zu der Erzeugung von Kohlenmonoxid (CO). Kohlenmonoxid wird seinerseits durch Reaktion mit OH innerhalb weniger Monate zu Kohlendioxid (CO2) oxidiert.
Die Lebensdauer von CO in der Atmosphäre ist also verhältnismäßig kurz, und die Konzentrationen dieses Gases können damit ziemlich stark schwanken. Auf der Nordhalbkugel findet man im Durchschnitt 2-3 Mal mehr CO als auf der Südhalbkugel, weil die Produktion hier höher ist. Solche Gase, die nicht mit OH reagieren, haben sehr lange Lebensdauer, wie z.B. die von der Industrie erzeugten FCKW-Gase, die eine mittlere atmosphärische Lebensdauer in der Größenordnung von 60-120 Jahren haben und deren verheerenden Einfluß auf die stratosphärische Ozonschicht wir schon besprochen haben.
Ozon und OH sind somit von grundlegender Bedeutung für die Chemie der Atmosphäre. Durch verschiedene Tätigkeiten bewirkt die Menschheit Änderungen auch in der Chemie der Troposphäre. Diese Änderungen wirken sich u. a. stark aus auf Ozon, OH, die Stickoxide NO und NO2, Methan und Kohlenmonoxid. Diese Gase stehen über chemische Prozesse miteinander in enger Beziehung. Ozon kann zum Beispiel während der Oxidation von Kohlenmonoxid zu Kohlendioxid erzeugt oder vernichtet werden, je nachdem, wieviel NOx sich in der Atmosphäre befindet. Die Oxidation kann über zwei Kreisprozesse ablaufen, bei denen OH, HO2, NO und NO2 als Katalysatoren wirken;
39
48